來源: 藥時空
概述
? ? 近年來,由于國家政策的支持,我國的生物醫(yī)藥產(chǎn)業(yè)正在成為發(fā)展最活躍的產(chǎn)業(yè)�����,醫(yī)藥研發(fā)進(jìn)展可謂日新月異�����。鑒于藥監(jiān)局的監(jiān)管政策在不斷更新�����,從事醫(yī)藥研發(fā)的企業(yè)和人員越來越多�����?����?紤]到從事醫(yī)藥研發(fā)的新人的增加�����,有必要將新藥研發(fā)的基本流程做一個簡單梳理�����。
? ? 現(xiàn)代藥物的概念除了我們傳統(tǒng)意義上的小分子化合物(如阿司匹林�����,青蒿素)�����,還包括多肽�����、蛋白質(zhì)和抗體�����,(寡)核苷酸�����,小分子—抗體復(fù)合物�����,還有疫苗�����。下面以傳統(tǒng)的小分子化合物藥為例�����,就新藥(主要以1.1類創(chuàng)新藥為例)研發(fā)從無到有�����,到最后上市的基本流程做一個概述�����。
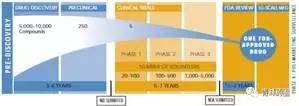
新藥的發(fā)現(xiàn)(Drug Discovery)
1.?藥物作用靶點(target)以及生物標(biāo)記(biomarker)的選擇與確認(rèn)
? ? 早期人們對藥物作用靶標(biāo)認(rèn)識有限�����,往往只知道有效�����,但不知如何起效。比如�����,百年來�����,人們知道阿司匹林(aspirin)具有解熱�����、消炎�����、止痛�����、抗血栓�����,甚至抗癌作用。直到1971年�����,英國人John R. Vane?在《Nature》期刊發(fā)文才闡明了Aspirin作用機理為抑制前列腺素合成�����,并于1982榮獲Nobel生理和醫(yī)學(xué)獎?����,F(xiàn)代生物醫(yī)學(xué)的研究進(jìn)展�����,以及人類基因圖譜的建立�����,讓人類對疾病的機理了解更加準(zhǔn)確�����,為新藥開發(fā)提供了明確的方向�����、具體的靶標(biāo)�����。
2.?先導(dǎo)化合物(lead compound)的確定
? ? 一旦選定了藥物作用的靶標(biāo)�����,藥物化學(xué)家(medicinal chemist)首先要找到一個對該靶標(biāo)有作用的化合物�����。這個化合物可以來自天然產(chǎn)物(動物�����、植物�����、海洋生物)�����;也可以是根據(jù)靶標(biāo)的空間結(jié)構(gòu),計算機模擬設(shè)計�����、合成的化合物�����;還可以根據(jù)文獻(xiàn)報道或以前其它項目的研究發(fā)現(xiàn)�����。比如�����,某一類化合物具有作用于該靶標(biāo)的藥理活性或副反應(yīng)等等�����。治療勃起障礙的藥物Viagra就是由其副作用開發(fā)而成�����。目前我們常用的方法是跟蹤國外研發(fā)機構(gòu)對某一靶標(biāo)的藥物開發(fā)�����,以他們的化合物作為先導(dǎo)�����,希望設(shè)計出更優(yōu)秀的化合物�����。
3.?構(gòu)效關(guān)系的研究與活性化合物的篩選
? ? 圍繞先導(dǎo)化合物�����,設(shè)計并合成大量新化合物�����,通過對所合成化合物活性數(shù)據(jù)與化合物結(jié)構(gòu)的構(gòu)效關(guān)系分析�����,進(jìn)一步有效的指導(dǎo)后續(xù)的化合物結(jié)構(gòu)優(yōu)化和修飾�����,以期得到活性更好的化合物。
4.?候選藥物(candidate)的選定
? ? 通過構(gòu)效關(guān)系研究�����,幾輪優(yōu)化所有篩選出來的滿足基本生物活性的最優(yōu)化合物�����,一般就選作為候選藥物�����,進(jìn)入開發(fā)�����。此時�����,從事新藥發(fā)現(xiàn)的藥物化學(xué)家工作暫告結(jié)束�����。

臨床前研究(Pre-clinic toxicology studies)
? ? 候選藥物確定后�����,新藥研發(fā)就進(jìn)入開發(fā)階段(development)�����,藥物開發(fā)第一階段的目標(biāo)就是完成臨床前的毒理學(xué)研究�����,向藥監(jiān)部門提交“實驗用新藥”(investigational new drug, IND?)申請�����。新藥開發(fā)需要多學(xué)科的協(xié)作�����,比如合成工藝(process chemistry)�����,毒理學(xué)�����,藥理學(xué),藥代動力學(xué)�����,制劑�����,等等各學(xué)科的協(xié)作�����,另外�����,所有專業(yè)都需要分析化學(xué)的支持�����。
1.?化學(xué)�����、制造和控制(Chemical Manufacture and Control, CMC)
? ? 新藥開發(fā)工作的第一步是原料藥合成工藝研發(fā)(Process R & D)�����,這是一個不斷改進(jìn)�����、完善的過程�����。第一批提供的原料藥主要用于毒理研究(100—1000g)�����,要求是越快越好�����,成本不是主要考慮因素�����。因此�����,只要藥化路線能夠?qū)崿F(xiàn)毒理批合成,工藝研發(fā)部門就會采用�����。但隨著項目的推進(jìn)�����,工藝部門會根據(jù)需要設(shè)計全新合成路線�����,開發(fā)合理生產(chǎn)工藝來滿足從I—III期臨床用藥與商業(yè)化的需求�����;同理�����,制劑部門首先也會以最簡單的形式給藥�����,完成毒理研究�����,然后不斷完成處方工藝研究�����,開發(fā)出商業(yè)化的制劑工藝�����。
?2.??藥代動力學(xué)(Pharmacokinetics, PK)
? ? 了解藥物在動物體內(nèi)的吸收�����、分布�����、代謝�����、排泄(ADME)�����,這些數(shù)據(jù)可以指導(dǎo)臨床研究以何種形式給藥(口服、吸入�����、針劑)�����,給藥頻率與劑量�����。
?3.?安全性藥理(Safety Pharmacology)
? ? 證明該化合物針對特定目標(biāo)疾病具有生物活性�����,同時評估藥物對療效以外的作用�����,比如可能的副作用�����,尤其是對心血管�����、呼吸�����、中樞神經(jīng)系統(tǒng)的影響�����。
?4.?毒理研究(Toxicology)
? ? 毒理研究種類較多�����,包括急性毒性�����、亞急性毒性�����、慢性毒性�����、生殖毒性、致癌性�����、致突變性等�����。為了加速新藥能及早驗證是否有療效�����,尤其是對一些抗癌藥�����,有些耗時費錢的毒理實驗(如致癌性�����、生殖毒性)是可容許在臨床試驗階段再進(jìn)行�����。
?5.?制劑開發(fā)
? ? 制劑開發(fā)是藥物研發(fā)的一個重要環(huán)節(jié)。早期制劑研究并不需要完整的處方開發(fā)�����,所有研究圍繞毒理學(xué)研究和一期臨床時方便給藥即可�����,目的是將候選藥物盡快推向臨床�����。隨著項目推進(jìn)�����,給藥方式和處方研究就越來越全面�����。比如�����,有的藥胃腸吸收很差�����,就需要開發(fā)為注射劑�����。有的藥對在胃酸里面會失去活性�����,就需要開發(fā)為腸溶制劑�����。有的化合物溶解性不好�����,也可以通過制劑來部分解決這個問題�����。
? ??前面這些內(nèi)容都統(tǒng)稱為臨床前研究�����,是藥物開發(fā)的第一階段。臨床前各個實驗的步驟可不是嚴(yán)格按照上述這個順序展開�����,而是一個相互包容�����、相互協(xié)調(diào)的關(guān)系�����。比如�����,原料藥工藝研發(fā)部門�����,完成毒理批樣品合成后�����,就必須立即開展合成路線的選擇�����,開發(fā)新的合成工藝�����,提供足夠量的原料藥以滿足制劑部門制劑研究用原料藥和9-12個月后開展I期臨床用藥的需求�����。
? ? ? 因此�����,項目推進(jìn)是否順利�����,就看各專業(yè)間的協(xié)調(diào)與配合是否密切了�����。
臨床研究(Clinical studies)
? ? 當(dāng)一個化合物通過了臨床前試驗后�����,需要向藥監(jiān)部門(C)FDA提交新藥臨床研究申請(IND),以便可以將該化合物應(yīng)用于人體試驗�����。新藥臨床研究申請需要提供先前試驗的材料�����;以及計劃將在什么地方�����,由誰以及如何進(jìn)行臨床試驗的說明�����;新化合物的結(jié)構(gòu)�����;給藥方式�����;動物試驗中發(fā)現(xiàn)的所有毒性情況�����;該化合物的制造生產(chǎn)情況�����。所有臨床方案必須經(jīng)過倫理審評委員會(Institutional Review Board�����,IRB)的審查和通過�����,每年還必須向FDA和IRB匯報一次臨床試驗的進(jìn)程和結(jié)果�����。在美國�����,如果在提交申請后30天內(nèi)FDA沒有駁回申請�����,那么該新藥臨床研究申請即被視為有效,可以進(jìn)行人體試驗�����。在中國則需要獲得CFDA正式批準(zhǔn)�����,方可進(jìn)入臨床�����。
Ⅰ期臨床試驗
? ? 在新藥開發(fā)過程中�����,將新藥第一次用于人體以研究新藥的性質(zhì)的試驗�����,稱之為Ⅰ期臨床試驗�����。這一階段的臨床試驗一般需要征集20-100名正常和健康的志愿者(對腫瘤藥物而言通常為腫瘤病人�����,但人數(shù)更少)�����,在嚴(yán)格控制的條件下�����,給不同劑量(隨著對新藥的安全性了解的增加�����,給藥的劑量也逐漸提高�����,并可以多劑量給藥)的藥物試驗于健康志愿者�����,住院以進(jìn)行24小時的密切監(jiān)護�����,仔細(xì)監(jiān)測藥物的血液濃度、排泄性質(zhì)和任何有益反應(yīng)或不良作用�����,以評價藥物在人體內(nèi)的性質(zhì)�����。同時也要通過這一階段的臨床試驗獲得其吸收�����、分布�����、代謝和排泄以及藥效持續(xù)時間的數(shù)據(jù)和資料�����;以及藥物最高和最低劑量的信息�����,以便確定將來在病人身上使用的合適劑量�����?����?梢?Ⅰ期臨床試驗是初步的臨床藥理學(xué)及人體安全性評價試驗�����,目的在于觀測人體對新藥的耐受程度和藥代動力學(xué)�����,為制定給藥方案和安全劑量提供依據(jù)�����。?
Ⅱ期臨床試驗
? ? 為了證實藥品的治療作用的�����,就必須在真正的病人身上進(jìn)行臨床研究�����,即Ⅱ期臨床試驗。Ⅱ期的臨床試驗通常需要征集100-500名相關(guān)病人進(jìn)行試驗�����。其主要目的是獲得藥物治療有效性資料�����。
? ? 將試驗新藥給一定數(shù)量的病人志愿者�����,評價藥物的藥代動力學(xué)和排泄情況�����。這是因為藥物在患病狀態(tài)的人體內(nèi)的作用方式與健康志愿者是不同的�����,對那些影響腸�����、胃、肝�����、和腎的藥物尤其如此�����。Ⅱ期臨床試驗一般通過隨機盲法對照試驗(根據(jù)具體目的也可以采取其他設(shè)計形式)�����,對新藥的有效性和安全性作出初步評價�����,并為設(shè)計Ⅲ期臨床試驗和確定給藥劑量方案提供依據(jù)�����。
Ⅲ期臨床試驗
? ? 當(dāng)一個新藥推進(jìn)到三期臨床�����,原料藥和制劑工藝研究也推進(jìn)到了相應(yīng)的階段�����。三期臨床用藥以商業(yè)化生產(chǎn)工藝提供臨床用藥�����。一般來講�����,商業(yè)化生產(chǎn)的原料藥生產(chǎn)工藝應(yīng)該考慮以下因素:產(chǎn)品質(zhì)量�����,生產(chǎn)安全性�����,生產(chǎn)成本�����,環(huán)境影響�����,生產(chǎn)的穩(wěn)定性和可持續(xù)性。
? ? Ⅲ期的臨床試驗通常需?1000-5000名臨床和住院病人�����,在醫(yī)生的嚴(yán)格監(jiān)控下�����,進(jìn)一步獲得該藥物的有效性資料和鑒定副作用�����,以及與其他藥物的相互作用關(guān)系�����。該階段試驗一般將對試驗藥物和安慰劑(不含活性物質(zhì))或已上市藥品的有關(guān)參數(shù)進(jìn)行對照和雙盲法試驗(醫(yī)生和病人都不知道自己吃的是新藥�����、老藥或安慰劑)�����,在更大范圍的病人志愿者身上�����,進(jìn)行擴大的多中心臨床試驗�����。最后�����,根據(jù)嚴(yán)格統(tǒng)計學(xué)數(shù)據(jù)分析�����,進(jìn)一步評價藥物的有效性和耐受性(或安全性)�����,決定新藥是否優(yōu)于(superior)或不差于(not inferior)市場現(xiàn)有的“老藥”�����。Ⅲ期臨床試驗是治療作用的確證階段�����,也是為藥品注冊申請獲得批準(zhǔn)提供依據(jù)的關(guān)鍵階段,該階段是臨床研究項目的最繁忙和任務(wù)最集中的部分�����,無疑是整個臨床試驗中最重要的一步�����。三期臨床研究往往持續(xù)好幾年�����。
? ? 除了對成年病人研究外�����,還要特別研究藥物對老年病人�����,有時還要包括兒童的安全性�����。一般來講�����,老年病人和危重病人所要求的劑量要低一些�����,因為他們的身體不能有效地清除藥物�����,使得他們對不良反應(yīng)的耐受性更差�����,所以應(yīng)當(dāng)進(jìn)行特別的研究來確定劑量�����。而兒童人群具有突變敏感性�����、遲發(fā)毒性和不同的藥物代謝動力學(xué)性質(zhì)等特點�����,因此在決定藥物應(yīng)用于兒童人群時,權(quán)衡療效和藥物不良反應(yīng)應(yīng)當(dāng)是一個需要特別關(guān)注的問題�����。在國外�����,兒童參加的臨床試驗一般放在成人試驗的Ⅲ期臨床后才開始�����。如果一種疾病主要發(fā)生在兒童�����,并且很嚴(yán)重又沒有其他治療方法�����,美國食品與藥品管理局允許Ⅰ期臨床試驗真接從兒童開始�����,即在不存在成人數(shù)據(jù)參照的情況下�����,允許從兒童開始藥理評價�����。我國對此尚無明確規(guī)定�����。
? ? 上述任何一步反饋得到的結(jié)果不好�����,都有可能讓一個候選藥物胎死腹中�����。最悲慘的結(jié)果可能是這個項目就直接被取消了�����。2007年�����,Merck有四個三期臨床藥物失敗。
? ? 能夠通過全部3期臨床評價而上市的新藥越來越少�����,部分原因是開發(fā)出比市場上現(xiàn)有藥物綜合評價更好的新藥越來越難�����。而一個藥物從源頭研發(fā)到3期臨床是一個耗資巨大的過程�����。公開數(shù)據(jù)表明�����,平均下來一個新藥要花費約為十億美金(1 billion US dollars)�����。正是因為藥物研發(fā)的耗資巨大�����,大公司花不起那么多錢同時展開多個項目研究�����,小公司又沒有那么多的財力完成藥物研發(fā)的全部流程?����,F(xiàn)在的藥物研發(fā)的一個趨勢是�����,小公司反而能夠更好的找準(zhǔn)市場上的空缺�����,開發(fā)出在臨床前研究階段具有良好表現(xiàn)的候選藥物�����。這時大公司通過并購小公司或者購買專利(或者使用權(quán))�����,將這個項目買過來繼續(xù)開發(fā)。如果是購買專利的情況�����,則會根據(jù)這個項目最后能夠進(jìn)展到哪個階段�����,完成后相應(yīng)得再支付給小公司一筆“獎金”�����,叫做milestone�����。
新藥申請(New drug application, NDA)
? ? 完成所有三個階段的臨床試驗并分析所有資料及數(shù)據(jù)�����,藥物的安全性和有效性得到了證明�����,新藥持有人則可以向藥監(jiān)部門(C)FDA提交新藥申請�����。新藥申請需要提供所有收集到的科學(xué)資料�����。通常一份新藥申請材料可多達(dá)100000?頁�����,甚至更多�����!按照法規(guī)�����,F(xiàn)DA應(yīng)在6個月內(nèi)審評完新藥申請�����。但是由于大部分申請材料過多�����,而且有許多不規(guī)范,因此往往不能在這么短的時間內(nèi)完成�����。中國藥監(jiān)局也在努力改進(jìn)工作�����,期望縮短審批時間�����。
批準(zhǔn)上市
? ? 新藥申請一旦獲得藥監(jiān)部門批準(zhǔn)�����,該新藥即可正式上市銷售�����,供醫(yī)生和病人選擇�����。但是新藥持有人還必須定期向藥監(jiān)部門呈交有關(guān)資料�����,包括該藥物的副作用情況和質(zhì)量管理記錄。對于有些藥物藥監(jiān)部門還會要求做第四期臨床試驗�����,以觀測其長期副作用情況�����。
? ? 如果能夠走到這一步�����,那么暫時可以說是大功告成了�����。從最開始的備選化合物走到這一步的藥物寥寥無幾�����。但是批準(zhǔn)上市了并不代表這個藥物就高枕無憂了�����。因為還有后面一步�����。

IV期臨床研究(藥物上市后監(jiān)測)
? ? 藥物在大范圍人群應(yīng)用后�����,需要對其療效和不良反應(yīng)繼續(xù)進(jìn)行監(jiān)測�����。藥監(jiān)部門要求根據(jù)這一階段的監(jiān)測結(jié)果來修訂藥物使用說明書�����。這一階段研究還會涉及到的一些內(nèi)容有�����,藥物配伍使用的研究�����,藥物使用禁忌�����。如果批準(zhǔn)上市的藥物在這一階段被發(fā)現(xiàn)之前研究中沒有發(fā)現(xiàn)的嚴(yán)重不良反應(yīng),比如顯著增加服藥人群心血管疾病發(fā)生率之類的�����,藥物還會被監(jiān)管部門強制要求加注警告說明�����,甚至下架�����。如Merck的抗關(guān)節(jié)炎藥物Vioxx?因增加心血管疾病風(fēng)險于2004?年“主動”撤離市場�����。?
? ? 總之�����,新藥研發(fā)是一個高風(fēng)險�����,高投入�����,當(dāng)然也是高回報的行業(yè)�����。研發(fā)周期長�����,涉及多學(xué)科�����、多專業(yè)的密切配合與協(xié)調(diào)�����。如果一個新藥研發(fā)機構(gòu)各專業(yè)職能部門配套合理�����,各專業(yè)人員能夠做好各自的本職工作,又注重各專業(yè)間的配合和與藥監(jiān)局的及時溝通�����,新藥研發(fā)管理并不復(fù)雜�����,只要有一個負(fù)責(zé)任的項目管理員�����,根據(jù)約定的項目關(guān)鍵時間節(jié)點及時協(xié)調(diào)各個職能部門的工作�����,項目就可按計劃有序進(jìn)行�����。
返回最上面
|